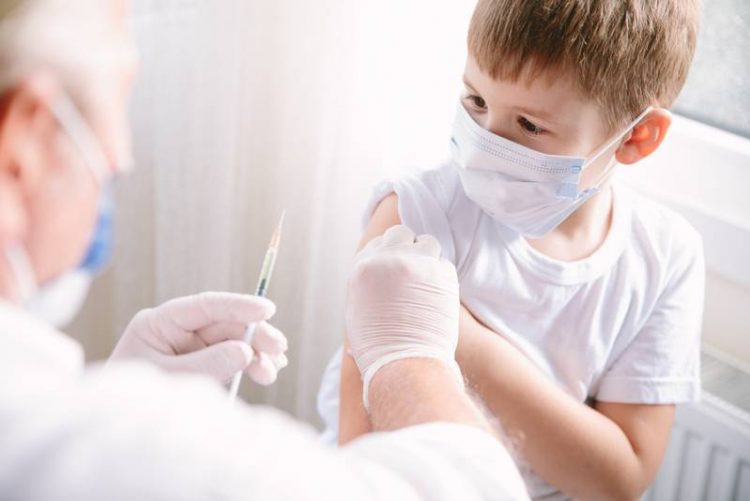
Pfizer prevé solicitar en noviembre próximo al regulador sanitario de Estados Unidos la autorización de su vacuna COVID-19 para menores de entre seis meses y cinco años, de acuerdo con un reporte del Financial Times.
La empresa espera publicar datos de sus ensayos clínicos sobre qué tan bien funciona su vacuna en niños de esas edades a finales de octubre, agregó su CEO, Albert Bourla, según un reporte de CNBC.
La vacuna, desarrollada en asociación con BioNTech, fue la primera en ser autorizada para su uso en menores de 12 años o más, y Pfizer ya había dicho que planeaba solicitar la aprobación de la Administración de Alimentos y Medicamentos para niños de entre cinco y 11 años a principios de octubre.
Las declaraciones del directivo se producen cuando muchos padres dicen que están ansiosos por vacunar a sus hijos, especialmente a medida que las escuelas vuelven a abrir y la variante Delta, altamente contagiosa, continúa propagándose.
La variante ha provocado un aumento de hospitalizaciones en Estados Unidos. Incluso entre niños pequeños que actualmente no son elegibles para recibir las vacunas.
Hasta ahora, la vacuna de Pfizer-BioNTech ha sido aprobada por la FDA para personas de tan solo 12 años, mientras que las vacunas de Moderna y Johnson & Johnson han sido autorizadas para adultos.
El viernes, funcionarios de la FDA dijeron que estaban “trabajando día y noche” para respaldar las aprobaciones de las vacunas COVID para niños menores de 12 años.
El doctor Peter Marks, el principal regulador de vacunas de la agencia, dijo el mes pasado que la autoridad sanitaria actuaría con la mayor “rapidez” posible para aprobar la vacuna para niños menores de 12 años una vez que las empresas presenten datos.
“Actualmente, todavía hay ensayos en curso, por lo que la agencia tiene que esperar a que la empresa envíe los datos para esos ensayos. Ciertamente queremos asegurarnos de hacerlo bien”, dijo el 23 de agosto.